Hace aproximadamente 560 millones de años, el primer sistema muscular estriado apareció en el ancestro cnidario de medusas y corales. Haootia quadriformis, que vivía anclada al fondo marino, probablemente utilizaba sus nuevas fibras musculares para agarrar alimento, una mejora con respecto a la filtración pasiva de su filo de esponjas.
Ryan Issa
Stuart Phillips ofreció una presentación en la Universidad de Cornell en octubre de 2025. Phillips presentó datos sobre los requerimientos de proteína dietética, compartiendo información sobre las cambiantes necesidades de proteína a lo largo de diferentes edades.
Desde entonces, los músculos han impulsado hazañas asombrosas: el vencejo alpino blanco vuela a 105 mph, los leones arrastran presas dos veces su peso, y los cocodrilos aplastan con una fuerza de mordida de 5,000 libras.
Sin embargo, ese poder tiene un precio. Cada contracción desgasta el músculo, y con la edad, la reparación se queda atrás con respecto a la degradación.
“La esencia del envejecimiento es que la entropía gana”, afirmó Stuart Phillips, profesor de kinesiología en la Universidad McMaster en Hamilton, Ontario. “Eventualmente, el sistema simplemente no puede mantener su integridad debido a mutaciones, daño oxidativo, acortamiento de telómeros, lo que sea.”
Phillips ha dedicado décadas a estudiar cómo el músculo esquelético se descompone, se regenera y se adapta, y cómo el estilo de vida, la nutrición y los procesos moleculares pueden ralentizar ese declive.
Científicos de otros campos también contribuyen al estudio del envejecimiento. Al investigar cómo otros animales utilizan sus músculos para trabajar más duro y durante más tiempo que los humanos, los biólogos evolutivos determinan qué mecanismos apuntar para la regeneración muscular humana.
Una pierna rota y una nueva dirección
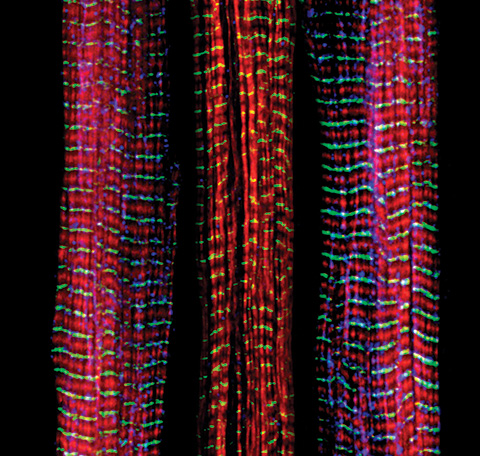
Christopher Pappas y Carol Gregorio, Universidad de Arizona
De las tres fibras musculares que se muestran aquí, la de la derecha y la de la izquierda son normales. La fibra del medio carece de una gran proteína llamada nebulina (azul). La nebulina desempeña un número de roles en la estructura y función de los músculos, y su ausencia está asociada con ciertos trastornos neuromusculares.
En 1989, Phillips regresó a McMaster para su último año. Un estudiante de bioquímica y capitán de rugby, estaba listo para la victoria, hasta que una pierna rota lo mantuvo en el banquillo durante meses.
“En ese momento estaba devastado”, dijo Phillips. “Y entonces tomé una tesis de fin de carrera y pasé tiempo en el laboratorio, y de repente me enamoré de la ciencia.”
Cuando le quitaron el yeso de cadera a tobillo después de 14 semanas, Phillips vio que su pierna se había atrofiado. Su mentor le explicó cómo se reconstruyen los músculos, y Phillips se sintió fascinado por su resiliencia. Su investigación de pregrado se convirtió en un proyecto de doctorado explorando la ingesta y síntesis de proteínas en atletas.
“Durante los primeros 15 años de mi carrera, me interesaba lo que podíamos hacer en personas más jóvenes”, dijo Phillips. “Y luego quizás la investigación se convirtió en ‘auto-investigación’ a medida que envejecía.”
Hoy en día, su trabajo se centra en ralentizar la pérdida muscular en adultos mayores. La reducción drástica de la masa muscular causa una condición conocida como sarcopenia, un declive relacionado con la edad en la masa y función muscular que reduce la movilidad, el equilibrio y la independencia.
La ciencia y el diagnóstico de la sarcopenia
La sarcopenia carece de marcadores genéticos o bioquímicos claros, por lo que los clínicos se basan en la observación.

William McDonald
William McDonald asesora a un paciente en su consulta. McDonald diagnostica la sarcopenia utilizando una combinación de visitas domiciliarias y pruebas prácticas.
“Quieres comprender su función física de referencia”, dijo William McDonald, un geriatra certificado. “¿Dónde estaban hace seis meses y hace cinco años, y cuando eran más jóvenes?”
El tamaño y la fuerza muscular disminuyen naturalmente con el tiempo, pero los pacientes a menudo experimentan un declive acelerado después de eventos como infecciones, hospitalizaciones o inmovilidad. McDonald dijo que las visitas domiciliarias son clave para evaluar la función en el mundo real: cómo los pacientes suben escaleras, cargan compras o usan andadores.
“Existen métricas de investigación como la circunferencia muscular”, dijo, “pero son difíciles de aplicar en un entorno clínico realista.”
Una prueba práctica es la evaluación de “levantarse y caminar”, en la que un paciente se levanta de una silla sin usar las manos.
“Debido a que (el paciente) tiene que levantarse en un corto período de tiempo, en realidad es la potencia la que lo saca de la silla, a diferencia de la fuerza”, dijo Phillips. “La rapidez es la manifestación externa de la potencia.”
Maquinaria molecular del movimiento
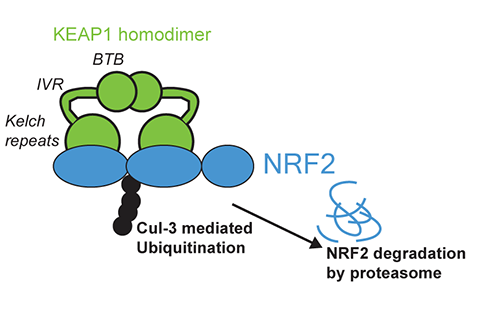
Gianni Castiglione
KEAP1 unido a NRF2. Cuando el músculo está en reposo, KEAP1 dirige a NRF2 a Cul-3 para la ubiquitinación y destrucción. El estrés oxidativo altera la conformación de KEAP1, permitiendo que NRF2 aún unido promueva la transcripción génica.
El músculo esquelético es uno de los tejidos más metabólicamente activos del cuerpo, constituyendo entre el 30 y el 40% de la masa total y funcionando bajo control voluntario. Su contracción depende de la adenosina trifosfato, o ATP, la molécula que impulsa cada contracción y flexión.
Durante el ejercicio, las reservas de ATP se agotan rápidamente y deben regenerarse por las mitocondrias. Este proceso también produce especies reactivas de oxígeno, o ROS, moléculas inestables que desempeñan roles duales: apoyando la señalización y la inflamación en niveles normales, pero causando estrés oxidativo y daño al ADN cuando se producen en exceso.
Para contrarrestar las ROS, las células despliegan una compleja defensa antioxidante compuesta por enzimas y antioxidantes no enzimáticos. Sin embargo, a medida que las personas envejecen, la eficiencia mitocondrial disminuye. La producción de ATP disminuye, la acumulación de ROS aumenta y las defensas antioxidantes se debilitan. Este desequilibrio contribuye a la atrofia muscular, la lenta recuperación y la reducción de la capacidad de ejercicio en adultos mayores.
Pistas moleculares de la evolución
Las raíces bioquímicas del envejecimiento muscular pueden remontarse a la evolución. Dos reguladores clave, el factor nuclear relacionado con el factor 2, o NRF2, y la proteína 1 asociada a Kelch-like ECH, o KEAP1, forman un interruptor molecular que ayuda a las células a responder al estrés oxidativo.

Gianni Castiglione
En la Universidad de Vanderbilt, Gianni Castiglione, un profesor asistente de ciencias biológicas, estudia estas proteínas en diferentes especies para comprender cómo la evolución afinó la resistencia muscular.
En los humanos, la actividad de NRF2 está estrictamente controlada por KEAP1, que contiene residuos de cisteína sensibles a la oxidación. En condiciones normales, KEAP1 se une a NRF2 y lo envía a la degradación en el proteasoma. Cuando aumenta el estrés oxidativo, las cisteínas de KEAP1 se oxidan, alterando su estructura y liberando a NRF2 al núcleo, donde desencadena la expresión génica antioxidante.
“Los antioxidantes son compuestos Goldilocks”, dijo Castiglione. “Demasiado (actividad antioxidante) es malo y puede crear estrés reductivo, lo que inhibe la señalización muscular.”
Cómo otros animales soportan el uso extremo de los músculos
Los caballos, por ejemplo, dependen de una producción muscular sostenida y potente. Sus músculos contienen más mitocondrias por centímetro cúbico que los humanos, generando más ATP y más ROS. Sin embargo, los caballos resisten el daño oxidativo que incapacitaría a los humanos.

Gianni Castiglione
Microscopía confocal que muestra el factor de transcripción NRF2 (verde) en fibroblastos de ánade real. Estas aves generan grandes cantidades de especies reactivas de oxígeno, o ROS, durante el vuelo y NRF2 resiste el daño celular por acumulación de ROS.
El laboratorio de Castiglione descubrió que una única mutación puntual en KEAP1 reduce su capacidad para inhibir a NRF2, lo que lleva a una mayor producción de antioxidantes y una mejor protección contra el estrés oxidativo.
“Siempre que las cisteínas se oxidan, cambia la conformación de KEAP1”, dijo Castiglione. “No libera a NRF2, simplemente altera cómo está unido.”
Este modelo de “bisagra y pestillo” permite que una parte de KEAP1 se desconecte mientras que el resto permanece conectado, manteniendo a NRF2 parcialmente comprometido. Como resultado, el NRF2 recién producido puede acumularse en el núcleo y fortalecer las defensas antioxidantes.
Las aves muestran adaptaciones similares. “Las mutaciones de NRF2 en humanos pueden provocar cáncer”, dijo Castiglione. “Y sin embargo, las aves tienen todas estas mutaciones y están prosperando, no a pesar de ellas, sino gracias a ellas.”
Estos estudios comparativos sugieren que la evolución ha reutilizado la misma maquinaria molecular para fines muy diferentes: adaptación en animales versus enfermedad en humanos.
Cuando la adaptación se vuelve perjudicial
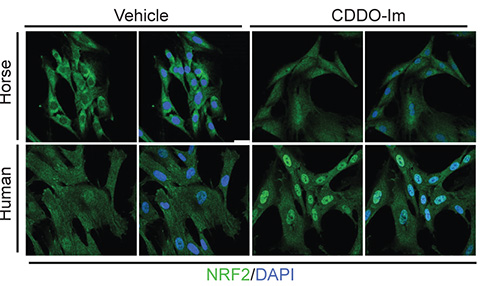
Gianni Castiglione
Imágenes de microscopía confocal de fibroblastos de caballo y humanos tratados con o sin un inhibidor de KEAP1, o CDDO-lm, que muestran que, en condiciones normales, KEAP1 previene la translocación y unión de NRF2 (verde) a los promotores de los genes de enzimas antioxidantes en el núcleo (azul).
En los humanos, la sobreproducción de NRF2 puede causar enfermedades. La activación constante favorece la supervivencia de las células cancerosas, permitiendo que los tumores manejen la alta actividad metabólica y el estrés por ROS.
“La alta actividad metabólica de una célula cancerosa es análoga a la alta actividad metabólica de un caballo o un ave”, dijo Castiglione. “Obtienes enfermedad o adaptación dependiendo del contexto.”
La hiperactividad de NRF2 también puede promover la aterosclerosis, una enfermedad inflamatoria crónica marcada por la acumulación de placa en las arterias. Sin embargo, a pesar de los riesgos, la activación controlada de NRF2 sigue siendo un objetivo atractivo para tratar enfermedades causadas por el estrés oxidativo, desde la neurodegeneración hasta la diabetes.
“Muchos (fármacos aprobados por la Administración de Alimentos y Medicamentos) se dirigen a NRF2 porque para muchas enfermedades diferentes, una característica común es el estrés oxidativo”, dijo Castiglione.
Prevención del declive
Equilibrar el estrés oxidativo comienza con el estilo de vida. Tanto Phillips como McDonald enfatizan que el ejercicio regular y la nutrición adecuada siguen siendo las formas más efectivas de preservar la salud muscular.

Los médicos recomiendan el entrenamiento de resistencia para aumentar la fuerza y la potencia muscular. La pérdida muscular con la edad no se puede prevenir, pero se puede ralentizar con elecciones de estilo de vida.
“El entrenamiento de resistencia es el rey, y una buena nutrición es la reina”, dijo Phillips. “Hasta que inventemos la píldora antienvejecimiento, nos quedan elecciones de estilo de vida.”
La sarcopenia no es inevitable. El entrenamiento de resistencia y fuerza, combinado con una ingesta adecuada de proteínas y vitamina D, puede ralentizar la pérdida muscular y preservar la independencia.
La biología evolutiva muestra que las especies ajustan las proteínas reguladoras de ROS en función de sus demandas musculares, ya sea volar, correr o nadar. Los humanos no pueden evolucionar tan rápido, pero el ejercicio desencadena cambios epigenéticos que mejoran la función muscular y la respuesta antioxidante incluso al final de la vida.
Ninguna cantidad de ejercicio aumentará la esperanza de vida de un humano. En cambio, Phillips dijo, las personas deberían centrarse en aumentar la “vida saludable”.
McDonald está de acuerdo: “Debemos ser realistas pero optimistas. Puede que no sea volver a correr un maratón, pero sí salir de casa a almorzar con amigos.”

